安徽/蚌埠-2025-04-29 00:00:00
农村妇女“两癌”检查项目管理方案(****年版)
为落实深化医药卫生体制改革重点工作任务,提高农村妇女宫颈癌和乳腺癌(以下简称“两癌”)的早诊早治率,降低“两癌”死亡率,提高广大农村妇女健康水平,逐步建立维护妇女健康的长效机制,****年,国家卫生计生委、财政部、全国妇联继续实施农村妇女“两癌”检查项目。
*****;一、项目目标
(一)****年完成****万*****岁农村妇女宫颈癌检查和***万乳腺癌检查。其中,在试点地区为**.*万*****岁农村妇女采用***检测方法进行宫颈癌初筛。
(二)进一步提高医疗保健人员的技术水平和服务质量,承担农村妇女“两癌”检查人员培训覆盖率达到**%以上。
*****;*****;*****;*****;(三)逐步提高农村妇女自我保健意识,项目地区妇女“两癌”防治知识知晓率达到**%以上。
*****;*****;*****;*****;(四)探索适合基层的妇女“两癌”检查服务模式和优化方案,逐步建立“两癌”防治体系长效机制。
*****;二、项目范围
(一)在全国**个省(区、市)开展农村妇女“两癌”检查,各省尽可能在同一项目地区整合开展宫颈癌、乳腺癌两项检查。
(二)在全国**个省(区、市)开展农村妇女宫颈癌***检测试点项目,每省(区、市)约*万人,原则上每个省(区、市)不超过*个县(区、市)。选点具体原则:
*.有工作基础,具备阴道镜检查及病理诊断能力,有***检测经验,以及具有上报全部***检测试点人群个案信息能力的县(区、市)优先考虑。
*.试点项目县(区、市)数量及选点由省级卫生计生行政部门结合本辖区实际情况确定,并报国家卫生计生委备案。
三、项目内容
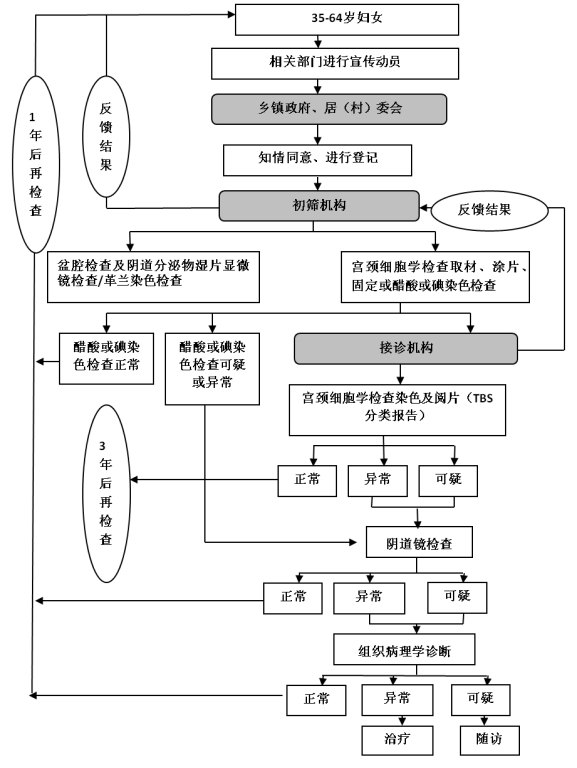
(一)延续宫颈癌检查项目。
*.妇科检查:包括盆腔检查及阴道分泌物湿片显微镜检查/革兰染色检查。
*.宫颈细胞学检查或醋酸染色检查/复方碘染色检查(以下简称***/****)。
宫颈细胞学检查:包括取材、涂片、固定、巴氏染色以及采用***描述性报告对宫颈细胞进行评价。
***/****检查:仅限于资源匮乏、没有宫颈细胞学检查条件(包括设备、阅片人员等)的地区使用。绝经后妇女不宜采用此法。
采用其他检查方法的,须经省级卫生计生行政部门认可,并报国家卫生计生委备案。
*.阴道镜检查:对宫颈细胞学检查或***/****检查结果异常/可疑者以及肉眼检查异常者进行阴道镜检查。
*.组织病理学检查:对阴道镜检查结果异常/可疑者进行组织病理学检查。延续宫颈癌检查项目检查流程图详见附件*。
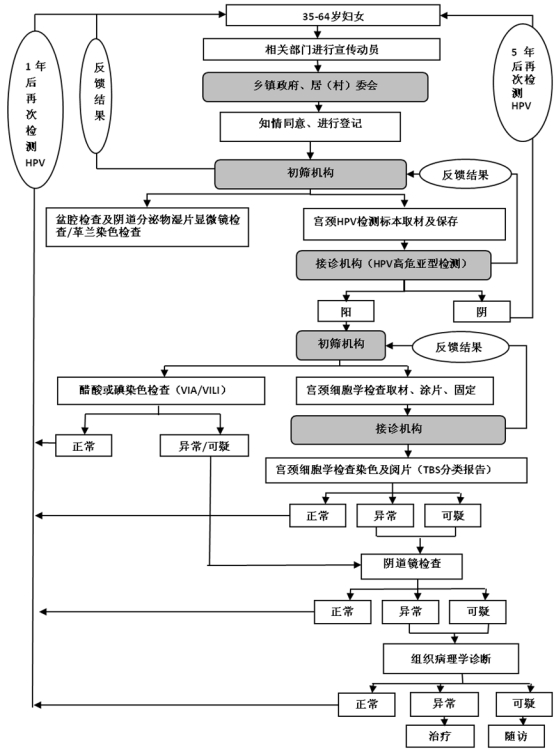
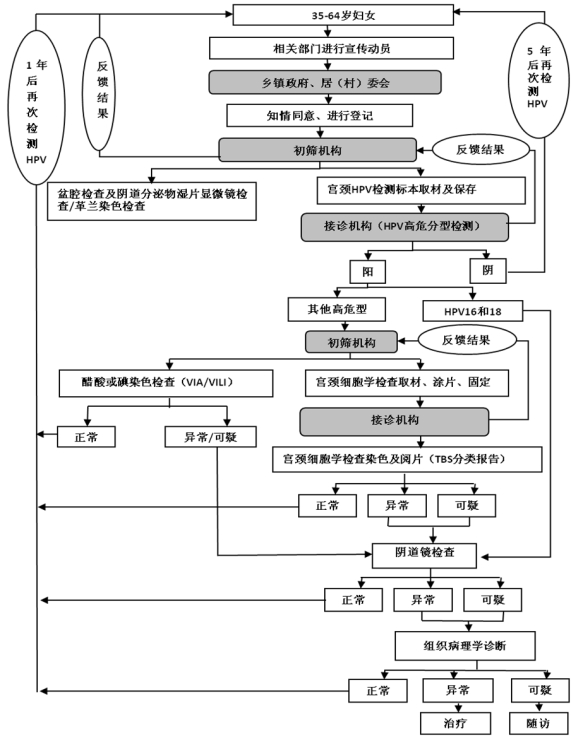
(二)***检测试点项目。
*.妇科检查:包括盆腔检查及阴道分泌物湿片显微镜检查/革兰染色检查。
*.*** 检测(***高危亚型检测或***高危分型检测):包括取材、保存、实验室检测及报告。***试剂所采用的技术平台及其产品至少要包含世界卫生组织明确确认的**种以上的高危型型别,包括:*****、**、**、**、**、**、**、**、**、**、**、**、**等亚型,确保检测质量。***检测试点项目***高危亚型检测和***高危分型检测流程图分别见附件*和*。
*.宫颈细胞学检查:对***高危亚型检测结果阳性或***高危分型检测结果为其他高危型者应当进行宫颈细胞学检查。包括取材、涂片、固定、染色以及采用***分类的描述性报告对宫颈细胞进行评价。
***/****检查:在资源匮乏、没有宫颈细胞学检查条件(包括设备、阅片人员等)的地区,可对***高危亚型检测结果阳性或***高危分型检测结果为其他高危型者进行***/****检查。
*.阴道镜检查:对***高危分型检测结果为**,**型、宫颈细胞学检查或***/****结果异常/可疑者以及肉眼检查异常者进行阴道镜检查。
*.组织病理学检查:对阴道镜检查结果异常/可疑者进行组织病理学检查。
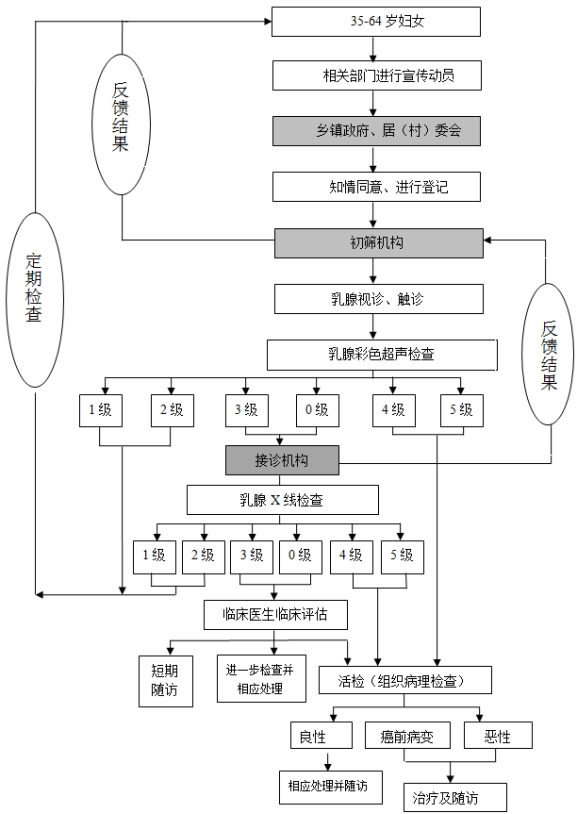
(三)乳腺癌检查项目。
*.乳腺触诊和乳腺彩超检查:对接受检查的所有妇女进行乳腺视诊、触诊和乳腺彩超检查,乳腺彩超检查结果采用乳腺影像分级评估报告系统(以下简称*******分级评估报告系统)。
*.乳腺*线检查:对乳腺彩超检查*******分级*级以及*级者,进行乳腺*线检查,乳腺*线检查结果采用*******分级评估报告系统。
*.组织病理检查:对乳腺彩超检查*******分级*级和*级、*线检查*******分级*级和*级者应当直接进行组织病理学检查(以下简称活检)。
*.对乳腺*线检查*级和*级者应当由副高以上专科医生综合评估后进行随访或活检或其他进一步检查。乳腺癌检查项目检查流程图详见附件*。
(四)加强检查异常/可疑病例管理。
随访人员要按照农村妇女宫颈癌和乳腺癌检查异常/可疑病例随访登记表(详见附件*和*)加强异常/可疑病例的追踪随访。要详细收集目标人群的基本信息,特别是联系方式。建立激励机制,充分发挥基层医生的作用,督促其尽早接受进一步检查。
*.宫颈癌检查异常/可疑病例。主要包括对***检测结果阳性者,宫颈细胞学检查***报告结果为未明确意义的不典型鳞状上皮细胞(以下简称******)及以上者、巴氏分级报告结果为***及以上者,肉眼观察异常/可疑者,***/****检查异常/可疑者,阴道镜检查异常/可疑者以及病理学检查结果为宫颈高级别病变(****和****)及以上者。
*****;*****;*****;*****;*.乳腺癌检查项目异常/可疑病例。主要包括乳腺彩超检查*******分级*级、*级及以上者,临床乳腺检查异常/可疑者,乳腺*线检查*******分级*级、*级及以上者,以及病理学检查为不典型增生及小叶原位癌、导管原位癌、浸润性乳腺癌等恶性病变。
(五)人员培训。
*.培训对象:为保证农村妇女“两癌”检查项目质量,应当对项目地区所有相关管理和专业技术人员进行培训。
*.培训方式:省级项目管理部门应当制订培训计划和统一培训教材,按照集中理论授课和临床技能操作相结合的原则,采取专家蹲点和临床进修等多种培训方式。要针对地区需要,确定培训重点,加强对新增项目地区的培训。
*.管理培训内容:项目实施方案、管理制度和要求、财务管理、项目监督、质量控制、信息收集和上报等。
*.技术培训内容:
(*)宫颈癌相关专业知识(流行病学、临床检查方法和规范、***检测及诊断标准等)。
(*)宫颈细胞学(涂片及染片方法和要点、***分类报告方法)、***/****、阴道镜、组织病理等检查的操作方法、注意事项、诊断标准及相关报告和信息登记表册填写要求等。
(*)***检测的操作方法、注意事项、诊断标准和相关报告信息的填写等。
(*)乳腺癌的相关专业知识(流行病学、临床检查方法、组织病理学检查方法和标准以及相关治疗知识等)。
(*)乳腺彩色超声和乳腺*线检查的操作方法、注意事项、*******分级评估报告系统和信息填写以及质量控制要求等。
(六)健康教育和社会宣传。
*.卫生计生部门积极主动协调妇联等部门,深入社区、家庭开展社会宣传,动员妇女主动接受“两癌”检查。
*.利用广播、电视、网络等媒体,广泛开展农村妇女“两癌”检查项目相关政策和妇女健康知识宣传,扩大农村妇女“两癌”检查项目的社会影响力,帮助广大妇女树立健康文明理念,培养良好的生活方式。
*.医务人员在项目实施过程中,应当积极主动地向接受检查妇女传播“两癌”防治核心信息,普及健康知识。为有需求的妇女提供咨询服务。
四、项目保障措施
(一)加强组织管理。
各级卫生计生行政部门要协调妇联等相关部门,组成本地区农村妇女“两癌”检查工作领导小组,负责本地区农村妇女“两癌”检查工作的组织、协调和监督指导;制定项目管理方案;落实有关经费;组织成立专家技术指导组;开展人员培训;管理相关信息;对项目进行监督管理,每年年底上报相关项目进展情况。
(二)明确相关职责。
卫生计生行政部门应当指定本辖区具有相应资质的医疗保健机构为农村“两癌”检查项目的初筛机构和接诊机构。初筛机构与接诊机构应当分工明确、密切协作,共同完成“两癌”检查任务。
初筛机构主要职责:采集病史、收集临床检查及辅助检查结果,提出医学建议,进行分类指导。对未发现异常情况者,提出定期筛查建议及预防保健指导;对筛查发现异常/可疑者,应当进行追踪随访,并提出进一步检查、诊断或转诊的建议;对筛查发现疾病并已明确诊断者,提出治疗或转诊的建议。在转诊时应当提供转诊对象的基本信息及相关检查资料,填写转诊单。初筛机构不具备细胞涂片染色和阅片能力的,应当将涂片送至指定的接诊机构进行诊断。初筛机构获得接诊机构反馈的结果后,应当在*个月内对异常/可疑病例进行随访,督促其进行进一步检查及治疗,并完成“两癌”检查项目个案登记表填写。
接诊机构主要职责:承担宫颈细胞学检查阅片、阴道镜、乳腺*线及组织病理学检查的接诊机构,应当指定专人接待转诊对象,对初筛结果异常者进行进一步诊治,并及时将检查结果反馈至初筛机构。
(三)建立摸底调查制度。
在检查前,项目地区街道办事处、乡镇政府组织有关人员,在公安、妇联、卫生计生、民政部门的支持下,对辖区内符合条件的适龄妇女进行摸底调查,登记需要检查人数。对符合条件的妇女,要积极动员其接受检查,签署“知情同意书”。要充分掌握应检人群的流动性,有计划、有组织地安排其持本人身份证或户口簿到指定的医疗保健机构进行检查。
(四)强化实验室管理。
各级卫生计生行政部门应当加强对承担农村妇女“两癌”检查项目医疗机构的实验室管理。配备与承担相关检查任务相适应的检测设备和合格的检验人员,完善相关工作制度,规范检测操作流程和结果报告。严格实验室质量控制,保障工作顺畅运转。承担检测任务的实验室应当及时向初筛部门反馈检测报告。
采用***检测方法进行***检测时,应当遵循《医疗机构临床基因扩增检验实验室管理办法》和《医疗机构临床基因扩增检验实验室工作导则》,建立***实验室,经过省级卫生计生行政部门技术审核合格后才能开展***检测工作。
(五)保障项目经费。
*****;*****;*****;*****;项目实施所需经费由中央和地方财政共同承担。各地要协调相关部门落实项目资金,加强资金监管,确保专款专用,并落实督导、培训、宣传动员和质量控制等工作经费,保障项目顺利实施。
五、信息收集和管理
*****;*****;*****;(一)项目信息通过国家妇幼重大公共卫生服务项目信息直报系统报送,内容包括农村妇女“两癌”检查项目季度统计表和个案登记表。报送范围如下:
*****;*****;*****;*****;*.宫颈癌检查项目
*****;*****;*****;(*)延续宫颈癌检查项目季度统计表(详见附件*)。
*****;*****;*****;(*)***检测试点项目季度统计表(详见附件*)。
*****;*****;*****;(*)农村妇女宫颈癌检查项目个案登记表(详见附件*)。
*****;*****;*****;*****;①延续宫颈癌检查项目:上报组织病理学检查结果为低级别病变(****)、高级别病变(****和****)、原位腺癌(***)、微小浸润癌(鳞癌/腺癌)、浸润癌(鳞癌/腺癌)及其他恶性肿瘤的个案信息。
*****;*****;*****;*****;②***检测试点项目:上报所有接受***检测初筛妇女(无论检测结果阴性或阳性)的个案信息。
*****;*****;*****;*****;*.乳腺癌检查项目
*****;*****;*****;(*)农村妇女乳腺癌检查项目季度统计表(详见附件**)。
*****;*****;*****;(*)农村妇女乳腺癌检查项目个案登记表(详见附件**)。
*****;*****;*****;*****;上报组织病理检查结果为不典型增生及小叶原位癌、导管原位癌、浸润性乳腺癌等恶性病变及其他恶性肿瘤的个案信息。
(二)项目地区应当有专人负责信息收集、整理,并以县(市、区)为单位进行报送。市级以上卫生计生部门应当在规定时间内完成数据审核。所有检查信息要及时录入,对检查异常的病例要加强追访,收集进一步检查、诊断结果及治疗结局的信息,失访率应≤*%,并按照要求及时上报。
六、质量控制
各级卫生计生行政部门按照国家项目管理方案及相关技术指南制订质量控制方案,定期对辖区内承担“两癌”检查任务的相关机构进行质控。接受质控的机构应当包括所有初筛机构、接诊机构及外送检测机构。
质控内容:项目管理工作流程、各项检查操作流程及结果、异常病例管理随访、信息上报的及时性、完整性和准确性等。对检查质量进行通报并提出改进措施。*****;
附件:*.延续宫颈癌检查项目检查流程图
*.***检测试点项目高危亚型检测流程图
*****;*****;*****;*****;*****;*****;*.***检测试点项目高危分型检测流程图
*****;*****;*****;*****;*****;*****;*.乳腺癌检查项目检查流程图
*****;*****;*****;*****;*****;*****;*.宫颈癌检查异常/可疑病例随访登记表
*****;*****;*****;*****;*****;*****;*.乳腺癌检查异常/可疑病例随访登记表
*****;*****;*****;*****;*****;*****;*.延续宫颈癌检查项目季度统计表
*****;*****;*****;*****;*****;*****;*.***检测试点项目季度统计表
*****;*****;*****;*****;*****;*****;*.农村妇女宫颈癌检查项目个案登记表
*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;**.农村妇女乳腺癌检查项目季度统计表
*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;**.农村妇女乳腺癌检查项目个案登记表
*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;**.农村妇女“两癌”检查项目报表说明
附件*
延续宫颈癌检查项目检查流程图
附件* *****;*****;*****;*****;*****;*****;*****;*****;*****;***检测试点项目
***高危亚型检测流程图
附件* *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;***检测试点项目
*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*** 高危分型检测流程图
附件*
*****;*****;*****;*****;*****;*****;乳腺癌检查项目检查流程图
附件*
宫颈癌检查异常/可疑病例随访登记表
|
登记日期 |
姓名 |
年龄 |
编号/身份证号 |
联系方式 |
***检查结果异常 |
宫颈癌细胞学检查情况 |
阴道镜检查情况 |
病理检查情况 |
治疗情况 |
备注 |
|||||||||||
|
结果 |
报告日期 |
结果 |
报告日期 |
是否检查 |
检查日期 |
检查结果 |
未查原因 *.失访 *.拒绝 *.其他 |
是否检查 |
报告日期 |
检查结果 |
是否失访 |
随访结果 |
|
||||||||
|
是否治疗 |
治疗日期 |
治疗方法 |
未治原因 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
填表说明:
*.*****;此随访表用于个案信息管理,不需上报。结果为异常/可疑病例者需要随访登记入此表中。
*.*****;异常/可疑病例主要包括:需要进一步检查及治疗者,如***检查结果异常、宫颈细胞学检查***分类******及以上或巴氏分级***及以上者,***/****检查异常/可疑者,阴道镜异常/可疑者以及病理学检查结果为****及以上者。
*.*****;阴道镜是否检查:不限定检查机构,只要进行了阴道镜检查的都作为已检查。
*.*****;阴道镜检查失访定义:指自告知应作阴道镜检查之日起至满*个月,仍未追踪到阴道镜检查结果者。
*.*****;阴道镜检查结果:填写正常或异常/可疑(异常/可疑者为需要进行病理学检查)。
*.*****;病理检查结果:如结果为****及以上者需要详细填写其病理检查结果。其中****及以上者需要进行随访了解治疗情况。
*.*****;是否治疗:填写是、否或不详。
*.*****;治疗方法:宫颈冷冻、宫颈****、宫颈锥切、子宫切除手术、放疗或化疗,其他请说明。
附件*
乳腺癌检查异常/可疑病例随访登记表
|
登记日期 |
姓名 |
年龄 |
编号/身份证号 |
联系方式 |
乳腺*超分类*级、*级及以上 |
乳腺*线检查情况 |
病理检查情况 |
治疗情况 |
备注 |
||||||||||
|
结果 |
报告 日期 |
是否检查 |
检查日期 |
检查结果 |
未查原因 *****;*.失访 *.拒绝 *.其他 |
是否检查 |
报告日期 |
检查结果 |
是否失访 |
随访结果 |
|||||||||
|
是否治疗 |
治疗日期 |
治疗方法 |
未治原因 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
填表说明:
*.*****;此随访表用于个案信息管理,不需上报。结果为异常/可疑病例者需要随访登记入此表中。
*.*****;异常/可疑病例主要包括:需要进一步检查者,如乳腺临床检查异常者,彩色*超检查*******分类为*级、*级及以上者;临床乳腺检查异常可疑者;乳腺*线检查*******分类为*级以及*级及以上者及病理检查结果为不典型增生及小叶原位癌、导管原位癌、浸润性乳腺癌等恶性病变。
*.*****;乳腺*线是否检查:不限定检查机构,只要进行了乳腺*线检查的都作为已检查。
*.*****;乳腺*线检查失访定义:指自告知应作乳腺*检查之日起至满*个月,仍未追踪到乳腺*线检查结果者。
*.*****;乳腺*线检查结果:填写***级。
*.*****;病理检查结果:如结果为不典型增生及以上者需要详细填写其病理检查结果,及治疗情况。
*.*****;是否治疗:填写是、否或不详。
*.*****;治疗方法:手术、化疗或放疗,其他请说明
附件*
延续宫颈癌检查项目季度统计表
(********年********季度)
|
项目县(区) |
检查人数 |
宫颈细胞学检查(人数) |
醋酸/碘染色 (人数) |
阴道镜检查 (人数) |
||||||||||||||||||
|
巴氏分级 |
***分类 |
|||||||||||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
|
|
年度任务数 |
检查人数 |
检查人数中既往接受过宫颈癌检查的人数 |
结案人数 |
正常 人数 |
报告 人数 |
***级及以上 |
报告 人数 |
不典型鳞状上皮细胞 (******) |
不除外高度鳞状上皮内病变 (*****) |
低度鳞状上皮内病变 (****) |
高度鳞状上皮内病变 (****) |
鳞状细胞癌 (***) |
不典型腺上皮细胞 (***) |
不典型颈管腺细胞倾向瘤变 |
颈管原位癌 |
腺癌 |
实查 |
异常/可疑 |
应查 |
实查 |
异常/可疑 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
生殖道感染(人数) |
生殖系统良性疾病(人数) |
组织病理检查 (人数) |
宫颈病变治疗随访情况 |
备注 |
|||||||||||||||||
|
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
|
|
总人数 |
滴虫性阴道炎 |
外阴阴道假丝酵母菌病 |
细菌性阴道病 |
外生殖器尖锐湿疣 |
黏液脓性宫颈炎 |
宫颈息肉 |
其他 |
子宫 肌瘤 |
其他良性疾病 |
应查 |
实查 |
低级别病变(****) |
高级别病变(****和****) |
原位 腺癌 (***) |
微小浸润癌 |
浸润癌 |
其他恶性肿瘤 |
随访人数 |
治疗 人数 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
附件*
***检测试点项目季度统计表
(********年********季度)
|
项目县(区) |
检查人数 |
***检测 (人数) |
宫颈细胞学检查(人数) |
醋酸/碘 染色 (人数) |
|||||||||||||||||
|
巴氏分级 |
***分类 |
||||||||||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
|
|
年度任务数 |
检查人数 |
检查人数中既往接受过宫颈癌检查的人数 |
结案人数 |
正常 人数 |
***检测阴性人数 |
***检测阳性人数 |
报告 人数 |
***级及以上 |
报告 人数 |
不典型鳞状上皮细胞(******) |
不除外高度鳞状上皮内病变 (*****) |
低度鳞状上皮内病变 (****) |
高度鳞状上皮内病变 (****) |
鳞状细胞癌 (***) |
不典型腺上皮细胞 (***) |
不典型颈管腺细胞倾向瘤变 |
颈管原位癌 |
腺癌 |
实查 |
异常/可疑 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
生殖道感染(人数) |
生殖系统良性疾病 (人数) |
阴道镜检查 (人数) |
组织病理检查 (人数) |
宫颈病变治疗随访情况 |
备注 |
|||||||||||||||||||||
|
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
|||
|
总人数 |
滴虫性阴道炎 |
外阴阴道假丝酵母菌病 |
细菌性阴道病 |
外生殖器尖锐湿疣 |
黏液脓性宫颈炎 |
宫颈息肉 |
其他 |
子宫 肌瘤 |
其他良性疾病 |
应查 |
实查 |
异常/可疑 |
应查 |
实查 |
低级别病变(原****) |
高级别病变(原****和****) |
原位 腺癌 (***) |
微小浸润癌 |
浸润癌 |
其他恶性肿瘤 |
随访人数 |
治疗 人数 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
附件*
农村妇女宫颈癌检查项目
个案登记表
编号:□□□□□□*□□*□□□*□□□□□
姓名:********* *****;*****;*****;*****;年龄:********* *****;*****;*****;*****;*****;*****;联系电话:*********
文化程度:*.小学及以下 *.初中 *.高中或中专 *.大专及以上 *****;*****;民族:*.汉 *.其他**** *****;*****;*****;*****;
身份证号:□□□□□□□□□□□□□□□□□□
住址:*********省********* 县(区)********* 乡(街道)****村(社区)****号
上报年份:*********年上报季度:第*********季度 *****;*****;*****;*****;*****;*****;*****;*****;*****;
|
(一)病史情况 |
||
|
症状 |
性交出血 |
无 *****;*****;*****;*****;*****;*****;*****;有 *****;*****;*****;*****;*****;*****; |
|
白带异常 |
无 *****;*****;*****;*****;*****;*****;*****;有 *****;*****;*****;*****;*****;*****; |
|
|
月经情况 |
周期 |
持续时间—天/周期—天 |
|
末次月经 |
****年****月*****;****日 |
|
|
绝经 |
否 *****;*****;*****;*****;*****;是,绝经年龄**************岁 |
|
|
目前使用避孕方法 |
*.未避孕 *****;*.避孕套 *****;*****;*.避孕药(年) *****;*.宫内节育器(年) *.其他避孕方法************** |
|
|
孕产史 |
孕次 *****;分娩次 |
|
|
既往接受过宫颈癌检查 *****;*****;*.是 *****;①三年内 *****;②三年以上 *****;*. 否 |
||
|
既往史 |
宫颈细胞学结果异常 |
持续( *****;)月 *****;结果************** |
|
***检查阳性 |
①*****;无 *****;*****;*****;②有,请注明************* |
|
|
*** |
①*****;无 *****;*****;*****;②有,请注明************** |
|
|
宫颈癌 |
①*****;无 *****;*****;*****;②有,请注明************** |
|
|
生殖道感染 |
①*****;无 *****;*****;*****;②有,请注明************** |
|
|
其他肿瘤 |
①*****;无 *****;*****;*****;②有,请注明************** |
|
|
家族肿瘤史 |
*.无 *.有,如有,请注明:疾病名称************** 患病家属与自己的关系: (*)一级亲属(父母、子女、亲兄弟姐妹(同父母)) (*)其他,请注明************************************ |
|
|
(二)妇科检查 |
||
|
外阴 |
*.正常*****;*****;*.白斑*****;*****;*.溃疡*****;*****;*.湿疣*****;*****;*.疱疹*****;*****;*.肿物 *.其他************** |
|
|
阴道 |
*.正常*****;*****;*.充血*****;*****;*.溃疡*****;*****;*.湿疣*****;*****;*.疱疹*****;*****;*.*****;肿物 *****;*.其他************** |
|
|
分泌物 |
*.正常*****;*****;*.*****;异味*****;*.*****;血性*****;*****;*.脓性*.*****;泡沫样*****;*****;*.豆渣样*.其他************** |
|
|
子宫颈 |
*.正常 *.触血*.息肉 *.糜烂样 *.菜花样*.其他************************** |
|
|
子宫 |
*.正常 *****;*.大小(正常、如孕周) *.肿物(大小、性状、位置)************** *.脱垂 *****;*.压痛 *.其他************************** |
|
|
附件(盆腔) |
*.正常 *****;*.压痛(左、右)*.肿物(左右)(大小、性状、位置)************** *.其他************************* |
|
|
分泌物检查 |
*.清洁度(Ⅰ度、Ⅱ度、Ⅲ度、Ⅳ度) *****;*****;*.滴虫 *****;*****;*****;*.假丝酵母菌 *.加德纳菌 *****;*****;*.线索细胞 *****;*****;*****;*.其他************************** |
|
|
妇科检查临床诊断 |
*.未见异常 *.异常 ①外生殖器尖锐湿疣②滴虫性阴道炎③外阴阴道假丝酵母菌病④细菌性阴道病 ⑤黏液脓性宫颈炎 ⑥宫颈息肉⑦子宫肌瘤⑧其他,请注明************** |
|
|
检查机构:************** |
检查人员:************** |
|
|
检查日期: *****;*****;*****;*****;年 *****;*****;*****;月 *****;*****;*****;日 |
||
|
(三)***检查 |
||
|
***检查 |
*.阴性 *.阳性 *****; (*) ***亚型,请勾选(**,**,**,**,**,**,**,**,其他请注明********) *****; (*)未分型 *****;*****;*****; |
|
|
需进一步检查 |
*.是( ①宫颈细胞学 *****;②***/**** *****;③阴道镜) *****;*****;*.否 |
|
|
检查机构:************** |
检查人员:************** |
|
|
检查日期:年月日 |
|
|
|
(四)宫颈细胞学检查 |
||||
|
宫颈细胞取材方式 |
*.巴氏涂片 *****;*****;*****;*.液基/薄层细胞学检查*****;*****;*****;*****;*.其他: ************** |
|||
|
巴氏分级 |
*.Ⅰ级 *****;*.Ⅱ* *****;*.Ⅱ* *****;*****;*.Ⅲ级 *****;*.Ⅳ级 *****;*****;*.Ⅴ级 |
|||
|
***分类报告结果 |
*.未见上皮内病变细胞和恶性细胞 |
|||
|
*.未明确意义的不典型鳞状上皮细胞(******) |
||||
|
*.不典型鳞状上皮细胞*不除外高度鳞状上皮内病变(*****) |
||||
|
*.低度鳞状上皮内病变(****) |
||||
|
*.高度鳞状上皮内病变(****) |
||||
|
*.鳞状细胞癌(***) |
||||
|
*.不典型腺上皮细胞(***) |
||||
|
*.不典型宫颈管腺细胞倾向瘤变 |
||||
|
*.宫颈管原位癌 |
||||
|
**.腺癌 |
||||
|
需阴道镜检查 |
*.是 *****;*****;*.否 |
|||
|
检查单位:************** |
报告人员:************** |
|||
|
报告日期: *****;*****;*****;*****;*****;年 *****;*****;*****;*****;*****;*****;月 *****;*****;*****;*****;*****;日 |
|
|||
|
(五)醋酸染色或复方碘染色后肉眼观察法检查(***/****) |
||||
|
醋酸染色后肉眼观察(***) |
在下图中用字母记录观察到的每一象限的最严重的异常病变 *=正常 *=异常 *=癌症 *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****; |
|||
|
碘染色后肉眼观察(****) |
*. 未见异常(染成深褐色) *****;*****;*****;*.异常或可疑癌(未被碘染色) 在下图中用字母记录观察到的每一象限的最严重的异常病变
|
|||
|
需做阴道镜检查 |
*.是 *****;*****;*****;*****;*****;*****;*****;*.否 |
|||
|
检查机构:************** |
检查人员:************** |
|||
|
检查日期: *****;*****;年 *****;*****;*****;月 *****;*****;*****;日 |
||||
|
(六)阴道镜检查 |
||
|
接受阴道镜检查 |
*.是(跳至“阴道镜检查评价”) *.否 |
|
|
未接受检查的原因 (跳至病理检查) |
*拒绝检查; *失访; *其他原因************* |
|
|
阴道镜检查评价 |
*.满意 *****;*****;*****;*****;*****;*****;*****;*.不满意 |
|
|
初步诊断 |
*.未见异常 *****;*****;*****;*****;*****;*****;*****;*.异常①低度病变 *****;②高度病变 *****;③可疑癌 ④其他,请注明************** *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****; |
|
|
需组织病理检查 |
*.是 *****;*****;*.否 |
|
|
检查单位:************** |
报告人员:************** |
|
|
检查日期: *****;*****;*****;*****;*****;年 *****;*****;*****;月 *****;*****;*****;日 |
||
|
(七)组织病理检查 |
||
|
组织病理学检查结果 |
*.未见异常 *****;*****; *.异常 ①炎症 *****;②低级别病变(原****) *****;③高级别病变(原*** *及****),④宫颈原位腺癌(***) ⑤宫颈微小浸润癌(鳞癌/腺癌) *****;⑥宫颈浸润癌(鳞癌/腺癌) ⑦其他,请注明************** *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****; |
|
|
诊断机构:************** |
报告人员:************** |
|
|
诊断日期 |
年 *****;*****;*****;月 *****;*****;*****;日 |
|
|
最后诊断 |
|
*.未见异常 *.异常:(包括组织病理检查结果和临床诊断) *****; (*)低级别病变(原****)(*)高级别病变(原*** *及****),(*)宫颈原位腺癌(***) (*)宫颈微小浸润癌(鳞癌/腺癌)(*)宫颈浸润癌(鳞癌/腺癌) (*)滴虫性阴道炎 *****; (*)外阴阴道假丝酵母菌病 *****;(*)细菌性阴道病 *****;(*)外生殖器尖锐湿疣 (**)子宫肌瘤 *****; (**)黏液脓性宫颈炎(**) 宫颈息肉(**)其他恶性肿瘤,请注明********** (**) 其他良性疾病,请注明**********(**)不详********** |
|
诊断机构:*******************;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;诊断人员:************** |
|
诊断日期: *****;*****;*****;*****;年 *****;*****;月 *****;日 |
|
随访治疗情况 |
|
宫颈病变随访情况:*.已随访 *****;*.失访 |
|
宫颈病变接受治疗:*.是 *****;*.否*****;*****;*.不详(注明原因)************** |
|
其他肿瘤随访情况:*.已随访 *****;*.失访 |
|
其他肿瘤接受治疗:*.是 *****;*.否*****;*****;*.不详(注明原因)************** |
|
随访机构:*******************;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;随访人员:************** |
|
随访日期: *****;*****;*****;*****;年 *****;*****;月 *****;日 |
|
备注 |
|
|
附件**
农村妇女乳腺癌检查项目季度统计表
(********年********季度)
|
项目县(区) |
检查人数 |
乳腺彩色超声检查结果(*******分级) (人数) |
乳腺*线检查结果(*******分级) (人数) |
|||||||||||||||||||||||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
** |
** |
** |
** |
** |
** |
** |
** |
** |
|||||||||||||||||||
|
年度 任务数 |
检查人数 |
检查人数中既往接受过乳腺癌检查的人数 |
结案人数 |
实查 人数 |
*级 |
*级 |
*级 |
*级 |
*级 |
*级 |
实查人数 |
*级 |
*级 |
*级 |
*级 |
*级 |
*级 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
乳腺良性疾病 (人数) |
组织病理检查 (人数) |
***分期 (人数) |
治疗随访情况(人数) |
备注 |
||||||||||||||||||||||||||||||||
|
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
** |
||||||||||||||||
|
乳腺纤维腺瘤 |
乳腺导管内乳头状瘤 |
其他 |
应查人数 |
实查人数 |
不典型增生 |
小叶原位癌 |
导管原位癌 |
浸润性导管癌 |
浸润性小叶癌 |
其他恶性肿瘤 |
应分期人数 |
获得分期人数 |
*期 |
*期 |
***期 |
***期 |
***期及以上 |
随访人数 |
治疗 人数 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
附件**
农村妇女乳腺癌检查项目
个案登记表
编号:□□□□□□*□□*□□□*□□□□□
姓名:********* 年龄:********* 联系电话:*********
文化程度:*.小学及以下 *.初中 *.高中或中专 *.大专及以上
民族:*.汉 *.其他*********
身份证号:□□□□□□□□□□□□□□□□□□
住址:********* 省********县(区)******乡(街道)******村(社区)******号
上报年份:******年上报季度:第******季度
|
(一)病史情况 |
||||||||||
|
月经情况 |
月经初潮年龄 |
****岁 |
||||||||
|
检查时末次月经 |
****年****月****日 |
|||||||||
|
绝经 |
*.否 *****;*****;*****;*****; *.是(绝经年龄****岁) *.不确定 |
|||||||||
|
孕产史 |
是否生产过 *****;*****; |
*.否 *****;*****;*****;*.是 |
||||||||
|
初产年龄 |
****岁 |
|||||||||
|
是否哺乳 *****;*****; |
*.否 *****;*****;*****;*.是 |
|||||||||
|
过去是否接受过乳腺检查 |
*.否 *.是 (*)最近一次检查时间:****年 (*)检查内容:(多选) ①手诊②超声③ *线④其他:请注明**************⑤不详 |
|||||||||
|
既往史 |
乳腺手术或活检史 |
*.无 *.有:****次, 注明病理结果(*)良性(*)恶性 |
||||||||
|
激素替代治疗史 |
*.无 *.有:注明用药时间****年(不足*年按*年计算) |
|||||||||
|
二级以内亲属乳腺癌或卵巢癌家族史 |
乳腺癌 *无 *有 患病家属与自己的关系: (*)一级亲属(父母、子女、亲兄弟姐妹(同父母)) (*)其他,请注明*************** |
卵巢癌 *无 *有 患病家属与自己的关系: (*)一级亲属(父母、子女、亲兄弟姐妹(同父母)) (*)其他,请注明*************** |
||||||||
|
(二)乳腺触诊 |
||||||||||
|
左乳 症状□无 □有□乳腺疼痛(周期性、非周期性) □乳头溢液(血性、浆液性、其它) 体征□未见异常 □乳房肿块或团块:最大径** □不对称性增厚或结节 □皮肤改变(详细描述) □腋淋巴结肿大 □其它(详细描述) |
右乳 症状□无 □有□乳腺疼痛(周期性、非周期性) □乳头溢液(血性、浆液性、其它) 体征□未见异常 □乳房肿块或团块:最大径** □不对称性增厚或结节 □皮肤改变(详细描述) □腋淋巴结肿大 □其它(详细描述) |
|||||||||
|
临床检查结果:*.未见异常 *****;*.良性病变(请注明 *********) *****;*.可疑恶性 |
||||||||||
|
检查机构:************ *****;检查人员:********** *****;检查日期:年月日 |
||||||||||
|
(三)乳腺彩色超声检查 |
||||||||||
|
超声评估 ******* 分级 |
左 *****;乳 囊肿□无 □有(□单纯囊肿□复杂囊肿) 实性肿块 □无 □有(□单发□多发) 部位: 象限法(可触及者): 时钟法(不可触及者): 大小:****** *****;*****;×****** 形态:□椭圆形□圆形□不规则□分叶状 方向:□纵横比≥* □纵横比<* 边界:□锐利□回声晕环 边缘:□清晰□不清晰 内部回声:□低□等□高□均匀□不均匀 后方回声:□无变化□衰减□增强□侧方声影 钙化灶:□无□粗大□细小 血 *****;流:□无□少许□丰富 其他(详细描述 *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;) |
*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;右 *****;乳 囊肿□无 □有(□单纯囊肿□复杂囊肿) 实性肿块 □无 □有(□单发□多发) 部位: 象限法(可触及者): 时钟法(不可触及者): 大小:****** *****;*****;×****** 形态:□椭圆形□圆形□不规则□分叶状 方向:□纵横比≥* □纵横比<* 边界:□锐利□回声晕环 边缘:□清晰□不清晰 内部回声:□低□等□高□均匀□不均匀 后方回声:□无变化□衰减□增强□侧方声影 钙化灶:□无□粗大□细小 血 *****;流:□无□少许□丰富 其他(详细描述 *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;) |
||||||||
|
分级 *****;□*级□*级□*级□*级□*级□*级 |
分级 *****;□*级□*级□*级□*级□*级□*级 |
|||||||||
|
建 议 |
*定期检查 *****;*.乳腺*线检查 *****;*.活检 |
|||||||||
|
检查机构 *****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;*****;检查人员:***** *****;检查日期: *****;*****;*****;*****;*****;年 *****;*****;*****;*****;月 *****;*****;*****;*****;日 |
||||||||||
|
(四)乳腺*线检查(未作*线检查不填写此项) |
||||||||||
|
乳腺*线评估*******分级(*级、*级及以上附报告单) |
左 *****;乳 分级□*级□*级□*级□*级□*级□*级 肿块□无 □有 *****;*****;*****;*****;大小:****** ×****** 可疑钙化 □无 □.有 结构紊乱 □无 □.有 部位:外上、外下、内上、内下象限、中央区、乳晕后 其他:****************** |
右 *****;乳 分级□*级□*级□*级□*级□*级□*级 肿块 □无 □有 *****;*****;*****;*****;大小:****** ×****** 可疑钙化 □无 □.有 结构紊乱 □无 □.有 部位:外上、外下、内上、内下象限、 中央区、乳晕后 其他:****************** |
||||||||
|
建 *****;议 |
*.定期检查 *****;*****;*.短期随访(*个月后复查乳腺*线) *.活检 *****;*.其他 |
|||||||||
|
检查单位:************** |
报告人员:************** |
|||||||||
|
报告日期:年月日 |
||||||||||
|
(五)最终随访结果 |
||||||||||
|
随访情况 |
*.已随访 *****;*****;*.失访 |
|||||||||
|
病理检查 |
*.已做 *****;*****;*.未做 *****;*****;*****;*.不详 |
|||||||||
|
病理检查机构:**************病理诊断者:************** |
||||||||||
|
病理检查日期:年月日 |
||||||||||
|
最后诊断 (以病理结果为准) |
*.未见异常 *.良性疾病 (*)乳腺纤维腺瘤(*)乳腺导管内乳头状瘤 (*)其他乳腺疾病(详述) *.癌前病变 (*)不典型增生(*导管不典型增生 *****;*****;*小叶不典型增生) (*)小叶原位癌 *.导管原位癌 *.浸润癌 (*)浸润性导管癌(*)浸润性小叶癌(*)其他类型(详述) |
|||||||||
|
***分期 |
*.临床分期(****) (*)获得①分期** * * 临床分期: 期 ②未分期 (*)未获得 *.病理分期(****) (*)获得①分期* * * * 病理分期: 期 ②未分期 (*)未获得 |
|||||||||
|
诊治机构:************** |
||||||||||
|
诊治日期:年月日 |
||||||||||
|
接受治疗情况 |
*.是 *****;*. 否 *.不详 |
|||||||||
附件**
农村妇女“两癌”检查项目报表说明
一、*****;农村妇女延续宫颈癌检查项目季度统计表指标解释
*.年度任务数:指本项目地区承担国家农村妇女延续宫颈癌检查项目的年度任务数(每季度均用本项目地区本年度同一任务数上报,注意不包括其他任务数)。
*. 检查人数:指本地区统计时段内进行妇科检查,并进行宫颈细胞学检查、或***/****检查的人数(即初筛人数)。
*.检查人数中既往接受过宫颈癌检查的人数:指检查人群中在过去接受过宫颈细胞学检查、或醋酸/碘染色、或***检测等宫颈癌检查的人数。
*.结案人数:指本地区统计时段内进行宫颈癌检查,并获得最后诊断、治疗结果和失访的人数(包括:检查结果为正常、异常及失访的人数)。
从第*项上报内容开始,以下皆为季报结案人数的数据汇总。
*.正常人数:指在结案人群中,经妇科检查以及各项宫颈癌检查未发现异常的人数。
*. 宫颈细胞学检查*巴氏分级报告人数:指本地区统计时段内进行宫颈细胞学检查并以巴氏分类标准填写报告的人数。
*. 宫颈细胞学检查****分类报告人数:指进行宫颈细胞学检查并以***分类标准填写报告的人数。
**. 醋酸/碘染色实查人数:指本地区统计时段内实际进行醋酸/复方碘染色肉眼观察检查的人数。
**. 醋酸/碘染色异常/可疑人数:指本地区统计时段内进行醋酸/复方碘染色肉眼观察检查结果提示宫颈异常/可疑,需要进一步进行阴道镜检查的人数。
**.阴道镜检查应查人数:包括宫颈细胞学检查***诊断系统报告未明确意义的不典型鳞状上皮细胞(******)及以上;巴氏分级系统报告Ⅱ*级及以上;***/****检查结果异常/可疑;肉眼直观为宫颈溃疡、肿块或可疑宫颈浸润癌等需直接进行阴道镜检查者。
**. 阴道镜检查异常/可疑人数:阴道镜检查结果异常/可疑需行组织病理学检查的人数。
**. 生殖道感染总人数:指根据病史、临床表现、实验室检查确诊为滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病、外生殖器尖锐湿疣、黏液脓性宫颈炎、宫颈息肉及其他生殖道感染之一的人数。如同一人患有多种感染则算作*人。
*****. 滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病患病人数:指根据病史、临床表现、实验室检查确诊的患病人数。
**. 外生殖器尖锐湿疣患病人数:指根据临床表现及肉眼观察结果诊断的患病人数。
**. 黏液脓性宫颈炎人数:指肉眼见到宫颈口脓性或黏液脓性分泌物且阴道分泌物白细胞计数≥**个/**,并需除外阴道炎。
**. 生殖道感染其他人数:指除滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病、外生殖器尖锐湿疣、粘液性宫颈炎、宫颈息肉以外的其他生殖道感染的患病人数。
**. 子宫肌瘤人数:指根据临床表现和超声检查诊断的患病人数。
**. 其他良性疾病人数:指除外妇科恶性肿瘤及本报表所列妇科疾病以外的其他妇科良性疾病的人数。
**. 组织病理检查应查人数:包括阴道镜检查结果异常/可疑;肉眼直观异常直接进行病理检查者。
**. 微小浸润癌:指按照国际妇产科联盟(****,****)的临床分期标准中***和***期。又称早期浸润癌,是指只能在显微镜下诊断而临床难以发现的浸润癌。***和***期应基于取出组织的显微镜检查,切除组织必须包含全部病变,不论原发病灶是鳞状上皮还是腺上皮,浸润深度不超过上皮基底膜下***,水平扩散不超过***。
**. 浸润癌:****临床分期标准**期及以上。
**. 其他恶性肿瘤人数:病理检查结果除宫颈低级别病变(****)、高级别病变(****和****)、原位腺癌(***)、微小浸润癌、浸润癌之外,病理检查结果报告的其他恶性肿瘤的人数。
**. 宫颈病变治疗随访人数:指对病理检查结果为高级别病变(****和****)、原位腺癌、微小浸润癌或浸润癌的患者,自告知患者应作治疗之日起满*个月,追踪到治疗结果的人数。
**. 宫颈病变治疗人数:指病理检查结果为高级别病变(****和****)、原位腺癌、微小浸润癌或浸润癌的患者接受了手术、化疗或放疗等方式治疗的人数。
**. 备注:填写其他恶性肿瘤的名称,及其他特殊情况。
二、农村妇女延续宫颈癌检查项目季度统计表逻辑关系
*.*≥*
*.*≥*
*.*≥*
*.*≥*+**+**+**+**+**+**+**+**
*.**≥**
*.**≥**≥**
*.**≥*+*+**+**+**+**+**+**+**+**+**
*.**≤**+**+**+**+**+**+**
*.**≥**
**.**≥**+**+**+**+**+**
**.**≤**≤**+**+**+**
*****;*****;*****;三、农村妇女宫颈癌***检测试点项目季度统计表指标说明
*.年度任务数:指本项目地区承担国家农村妇女宫颈癌***检测试点项目的年度***检查任务数(每季度均用本项目地区本年度同一任务数上报,注意不包括其他任务数)。
*. 检查人数:指本地区统计时段内进行妇科检查,并进行***检测的人数(即初筛人数)。
*.检查人数中既往接受过宫颈癌检查的人数:指检查人群中在过去接受过宫颈细胞学检查、或醋酸/碘染色、或***检测等宫颈癌检查的人数。
*.结案人数:指本地区统计时段内进行宫颈癌检查,并获得最后诊断、治疗结果和失访的人数(包括:检查结果为正常、异常及失访的人数)。
从第*项上报内容开始,以下皆为季报结案人数的数据汇总。
*.正常人数:指在结案人群中,经妇科检查以及各项宫颈癌检查未发现异常的人数。
*.***检测阳性人数:应用********;***检测方法进行宫颈癌初筛,结果报告为高危亚型(包括分型)阳性的人数。
*.*****;宫颈细胞学检查*巴氏分级报告人数:指本地区统计时段内进行宫颈细胞学检查并以巴氏分类标准填写报告的人数。
**.宫颈细胞学检查****分类报告人数:指进行宫颈细胞学检查并以***分类标准填写报告的人数。
**. 醋酸/碘染色实查人数:指本地区统计时段内实际进行醋酸/复方碘染色肉眼观察检查的人数。
**. 醋酸/碘染色异常/可疑人数:指本地区统计时段内进行醋酸/复方碘染色肉眼观察检查结果提示宫颈异常/可疑,需要进一步进行阴道镜检查的人数。
**.生殖道感染总人数:指根据病史、临床表现、实验室检查确诊为滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病、外生殖器尖锐湿疣、黏液脓性宫颈炎、宫颈息肉及其他生殖道感染之一的人数。
*****.滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病患病人数:指根据病史、临床表现、实验室检查确诊的患病人数。
**.*****;外生殖器尖锐湿疣患病人数:指根据临床表现及肉眼观察结果诊断的患病人数。
**.黏液脓性宫颈炎人数:指肉眼见到宫颈口脓性或黏液脓性分泌物且阴道分泌物白细胞计数≥**个/**,并需除外阴道炎。
**.生殖道感染其他人数:指除滴虫性阴道炎、外阴阴道假丝酵母菌病、细菌性阴道病、外生殖器尖锐湿疣、黏液性宫颈炎、宫颈息肉以外的其他生殖道感染的患病人数。
**.子宫肌瘤人数:指根据临床表现和超声检查诊断的患病人数。
**.其他良性疾病人次数:指除外妇科恶性肿瘤及本报表所列妇科疾病以外的其他妇科良性疾病的人次数。
**.阴道镜检查应查人数:包括宫颈细胞学检查***诊断系统报告未明确意义的不典型鳞状上皮细胞(******)及以上;巴氏分级系统报告Ⅱ*级及以上;***/****检查结果异常/可疑;肉眼直观为宫颈溃疡、肿块或可疑宫颈浸润癌等需直接进行阴道镜检查者。
**.*****;阴道镜检查异常/可疑人数:阴道镜检查结果异常/可疑需行组织病理学检查的人数。
**.组织病理检查应查人数:包括阴道镜检查结果异常/可疑;肉眼直观异常直接进行病理检查者。
**.微小浸润癌:指按照国际妇产科联盟(****,****)的临床分期标准中***和***期。又称早期浸润癌,是指只能在显微镜下诊断而临床难以发现的浸润癌。***和***期应基于取出组织的显微镜检查,切除组织必须包含全部病变,不论原发病灶是鳞状上皮还是腺上皮,浸润深度不超过上皮基底膜下***,水平扩散不超过***。
**. 浸润癌:****临床分期标准Ⅰ*期及以上。
**.其他恶性肿瘤人数:病理检查结果除了宫颈低级别病变(原****)、高级别病变(原****和****)、原位腺癌(***)、微小浸润癌、浸润癌之外,病理检查结果报告的其他恶性肿瘤的人数。
**.宫颈病变治疗随访人数:指对病理检查结果为高级别病变(原****和****)、原位腺癌、微小浸润癌或浸润癌的患者,自告知患者应作治疗之日起满*个月,追踪到治疗结果的人数。
**.宫颈病变治疗人数:指病理检查结果为高级别病变(原****和****)、原位腺癌、微小浸润癌或浸润癌的患者接受了手术、化疗或放疗等方式治疗的人数。
**.备注:填写其他恶性肿瘤的名称,及其他特殊情况。
四、农村妇女宫颈癌***检测试点项目季度统计表逻辑关系
*.*****;*≥*
*.*****;*≥*
*.*****;*=*+*
*.*****;*≥*+**+**
*.*****;*≥*
*.*****;**≥**+**+**+**+**+**+**+**+**
*.*****;**≥**
*.*****;**≤**+**+**+**+**+**+**
*.*****;**≥*+**+**+**+**+**+**+**+**+**+**
**.*****;**≥**≥**
**.*****;**≥**
**.*****;**≥**+**+**+**+**+**
**.*****;**≤**≤**+**+**+**
五、农村妇女宫颈癌检查项目个案登记表填表说明
*.表格编号说明
所有接受检查的个人资料需要统一编码,编码共**位,第*~*位为项目地区编码,是由国家统一编制的行政区划代码,其中包括省编码*位、地市编码*位、县区编码*位;*~*为乡镇/街道编码*位,*~**为行政村/居委会编码*位;第**~**位为检查对象顺序编码(是被抽样行政居委会/村内检查对象的顺序编码)。
例如:辽宁省本溪市平山区站前街道迎宾居委会第****名检查对象编码可设为*******************。
|
行政区划代码 |
街道编码 |
居委会编码 |
检查对象顺序编码 |
||||||||||||
|
辽宁省本溪市平山区 |
站前街道 |
迎宾居委会 |
第****名检查对象 |
||||||||||||
|
第*~*位 |
第*~*位 |
第*~**位 |
第**~**位 |
||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
如果抽取的居民/村民小组中检查对象数量少于样本量要求,应追加抽取附近的居民/村民小组,追加抽取的居委会/村的编码顺次为“**、**……”,如果该乡(镇)/街道所有村/居委会中检查对象仍少于样本量要求,则追加抽取附近的乡(镇)/街道,追加抽取的乡(镇)/街道编码顺次为“**、**……”。
例如:辽宁省本溪市平山区站前街道所选取的迎宾居委会中检查对象少于样本量要求,则追加抽取丰盛居委会中的符合条件的检查对象,则丰盛居委会中某检查对象为站前街道第****名检查对象,其编码可设为*******************。
|
行政区划代码 |
街道编码 |
居委会编码 |
检查对象顺序编码 |
||||||||||||
|
辽宁省本溪市平山区 |
站前街道 |
丰盛居委会 |
第****名检查对象 |
||||||||||||
|
第*~*位 |
第*~*位 |
第*~**位 |
第**~**位 |
||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
*.逻辑关系
******;怀孕次数≥分娩次数(如为双胎分娩次数填写*次)
*.阴道镜检查失访定义
阴道镜检查失访指,自告知应作阴道镜检查之日起至满*个月,仍未追踪到阴道镜检查结果者。
*. 最后诊断异常定义:
最后诊断异常包括组织病理学检查结果异常、临床及化验室检查结果异常情况,包括宫颈癌前病变及宫颈癌、生殖道感染性疾病及其他良性疾病等。如阴道镜组织病理检查结果和手术病理检查结果不相符,应填报病变严重者。
*.常见子宫颈病变的病理诊断名称及描述
(*)阴性/炎症
(*)低级别鳞状上皮内病变(****):包括*** *、***染色阴性的*** **级病变、***感染所致的湿疣病变。
(*)高级别鳞状上皮内病变(****):包括***染色阳性的*** **、******以及以前旧命名的重度非典型增生和原位癌。
(*)宫颈原位腺癌 (***)。
(*)浅表(早期或微小)浸润癌(包括鳞状细胞癌和腺癌)。
(*)宫颈浸润癌(包括鳞状细胞癌和腺癌)。
(*)其他:上述病理诊断内容不能涵盖的病变,如小细胞癌,肉瘤等按照***分类诊断命名。
*.治疗失访定义
治疗失访指自告知应做手术、化疗或放疗等方式的治疗之日起满*个月,仍未追踪到结果者。
*.接受治疗定义
接受治疗指病理检查结果为宫颈高级别病变(原****及****)、原位腺癌、微小浸润癌、浸润癌及其他生殖道恶性肿瘤的患者接受了手术、化疗或放疗等方式的治疗。
*.填写个案卡时请在相应选项上画圈。
*****;六、农村妇女乳腺癌检查项目季度统计表指标解释
*.年度任务数:指本项目地区承担国家农村乳腺癌检查项目的年度任务数(每季度均用本项目地区本年度同一任务数上报,注意不包括其他任务数)。
*.检查人数:指本地区统计时段内进行乳腺临床及彩色超声检查的人数(即初筛人数)。
*.检查人数中既往接受过乳腺癌检查的人数:指检查人群中在过去接受过乳腺临床、彩色超声、乳腺*线摄片等方法检查的人数。
*.结案人数:指本地区统计时段内进行乳腺癌检查,并获得最后诊断、治疗和失访的人数(包括:检查结果为正常、异常及失访的人数)。
从第*项上报内容开始,以下皆为季报结案人数的数据汇总。
**.其他乳腺良性疾病:除乳腺纤维腺瘤和乳腺导管内乳头状瘤以外的其他乳腺良性疾病,不包括乳腺增生。
**.组织病理检查应查人数:乳腺超声检查结果*级、*级,乳腺*线检查结果*、*级,以及临床医生综合评估后进行病理检查者(指乳腺*线检查后*级和*级需活检者)。
**.组织病理检查实查人数:随访到的患者中有病理检查结果的人数。
**.其他恶性肿瘤:病理检查结果除了不典型增生、小叶原位癌、导管原位癌、浸润性导管癌、浸润性小叶癌之外,病理检查结果报告的其他恶性肿瘤的人数。
**. ***分期应分期人数:指应对小叶原位癌、导管原位癌、浸润性导管癌、浸润性小叶癌及其他恶性肿瘤进行分期的人数。
**.***分期获得分期人数:指实际获得小叶原位癌、导管原位癌、浸润性导管癌、浸润性小叶癌及其他恶性肿瘤的病理分期(****)和/或临床分期(****)的人数。
*****.指病理分期或者临床分期的具体期别。优先填写病理分期,如未获得病理分期,则填写临床分期。
**.治疗随访人数:指对病理检查结果为不典型增生、小叶原位癌、导管原位癌、浸润性导管癌、浸润性小叶癌及其他恶性肿瘤的患者,自告知患者应作治疗之日起满*个月,追踪到治疗结果的人数。
**.治疗人数:指组织病理检查结果为不典型增生、小叶原位癌、导管原位癌、浸润性导管癌、浸润性小叶癌及其他恶性肿瘤患者接受治疗的人数。
**.备注:填写其他恶性肿瘤的名称,及其他特殊情况。
*****;*****;七、农村妇女乳腺癌检查项目季度统计表逻辑关系
*.*****;*≥*
*.*****;*≥*
*.*****;*=*+*+*+*+**+**
*.*****;**=**+**+**+**+**+**
*.*****;**≥**≥**+**+**+**+**+**
*.*****;**≥**
*.*****;**=**+**+**+**+**
*.*****;**≥**
*.*****;**≤**+**+**+**+**+**
*****;*****;八、农村妇女乳腺癌检查项目个案登记表填表说明
*.检查表格编号说明
所有接受检查的个人资料需要统一编码,编码共**位,第*~*位为项目地区编码,是由国家统一编制的行政区划代码,其中包括省编码*位、地市编码*位、县区编码*位;*~*为乡镇/街道编码*位,*~**为行政村/居委会编码*位;第**~**位为检查对象顺序编码(是被抽样行政居委会/村内检查对象的顺序编码)。
例如:辽宁省本溪市平山区站前街道迎宾居委会第****名检查对象编码可设为*******************。
|
行政区划代码 |
街道编码 |
居委会编码 |
检查对象顺序编码 |
||||||||||||
|
辽宁省本溪市平山区 |
站前街道 |
迎宾居委会 |
第****名检查对象 |
||||||||||||
|
第*~*位 |
第*~*位 |
第*~**位 |
第**~**位 |
||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
如果抽取的居民/村民小组中检查对象数量少于样本量要求,应追加抽取附近的居民/村民小组,追加抽取的居委会/村的编码顺次为“**、**……”,如果该乡(镇)/街道所有村/居委会中检查对象仍少于样本量要求,则追加抽取附近的乡(镇)/街道,追加抽取的乡(镇)/街道编码顺次为“**、**……”。
例如:辽宁省本溪市平山区站前街道所选取的迎宾居委会中检查对象少于样本量要求,则追加抽取丰盛居委会中的符合条件的检查对象,则丰盛居委会中某检查对象为站前街道第****名检查对象,其编码可设为*******************。
|
行政区划代码 |
街道编码 |
居委会编码 |
检查对象顺序编码 |
||||||||||||
|
辽宁省本溪市平山区 |
站前街道 |
丰盛居委会 |
第****名检查对象 |
||||||||||||
|
第*~*位 |
第*~*位 |
第*~**位 |
第**~**位 |
||||||||||||
|
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
* |
*.绝经中“不确定”的定义
年龄<**岁的子宫切除术后为不确定。
*.乳腺超声评估*******分级描述
乳腺超声筛查描述的重点病灶是指可疑恶性的病灶和最大的实性良性病灶。
(*)*****;如果有多个病灶,应描述可疑乳腺癌的病灶;
(*)*****;如果考虑均为良性,则描述肿块最大的病灶;
(*)*****;如果复杂性囊肿可疑恶性,则予以重点描述;
(*)*****;如果有多个可疑恶性病灶,除过描述最大的以外,其它者可在补充描述中指出。
具体描述如下:
*级:现有影像未能完成评估,需要其他影像检查进一步评估或与既往检查比较。
*级:阴性,超声上无异常发现。
*级:良性发现,基本上可以排除恶性。
*级:良性可能性大,建议短期随访。
*级:可疑恶性,应考虑活检。
*级:高度提示恶性,应积极处理。
*.乳腺*线检查*******分级描述
如果有多个病灶,应注明最高级别的病灶。具体描述如下:
*级:现有影像未能完成评价,需要增加其它影像检查,包括加压点片、加压放大、加拍其它体位,或行超声检查。
*级:阴性,乳腺*线检查无异常发现。
*级:肯定良性发现,存在明确的良性病灶,无恶性征象。
*级:良性可能大的病灶(恶性可能性<*%),建议短期随访。
*级:可疑异常,但不具备典型的恶性征象(恶性可能性****%),应考虑活检。
*级:高度提示恶性的病灶(恶性可能性>**%),有典型乳腺癌的影像学特征,临床应采取适当措施。
*.最终随访结果中失访定义
指自告知应作病理检查或手术治疗之日起满*个月,仍未追踪到结果者。
*.最后诊断(病理结果)中其他乳腺良性疾病
包括乳腺脂肪瘤、乳腺平滑肌瘤、乳腺错构瘤、乳腺神经纤维瘤、乳腺神经鞘瘤、乳腺血管瘤、乳腺颗粒细胞瘤、乳腺淋巴管瘤、乳腺大汗腺腺瘤、乳头腺癌、乳腺叶状肿瘤等。
*.最后诊断(病理结果)中乳腺癌其他类型
包括病理诊断为小管癌、浸润性筛状癌、髓样癌、分泌粘液的癌、神经内分泌肿瘤、浸润性乳头状癌、浸润性微乳头状癌、大汗腺癌、化生性癌、富脂质癌、分泌型癌、炎症性癌等。
*.乳腺癌***分期的填写
(*)临床分期(****分期)
通过物理诊断、影像学检查、病理活检等手段得到肿瘤分期的信息。往往是医师对患者治疗前进行诊断时所作出的分期。
(*)病理分期(****分期)
仅限于接受确定性手术和术后病理检查的病例,是综合了临床分期和手术结果所作出的分期。
*.接受治疗定义
指病理检查结果为不典型增生性病变、原位癌、导管内乳头状癌、微小浸润癌或浸润癌及乳腺其他恶性肿瘤的患者接受了手术、化疗或放疗等方式的治疗。
**.填写个案卡时请在相应数字选项上画圈,或在相应□上画√。



